K. Mahé – Hôpital Henri-Mondor, Créteil
C’est par une présentation de J-P Cottier que commence la séance avec un aperçu de la nouvelle classification WHO et l’apport important des mutations génétiques à rechercher. En première ligne, la mutation du gène IDH renseigne sur la réponse à la chimiothérapie et est à rechercher dans les glioblastomes de grade IV, cela est de toute importance car son absence permet d’éviter une résection élargie. Ce diagnostic de mutation IDH entraine une accumulation de 2-hydroxyglutarate détectable en spectroscopie. La SRM apparait alors comme une méthode sensible très bien corrélée à la survie. Autre mutation mise en avant, la codélétion 1p/19q permet de déterminer la nature histologique de la lésion en orientant notamment vers les oligodendrogliomes qui présenteront certaines caractéristiques dont les plus évocatrices seront les calcifications périphériques enrubannées.
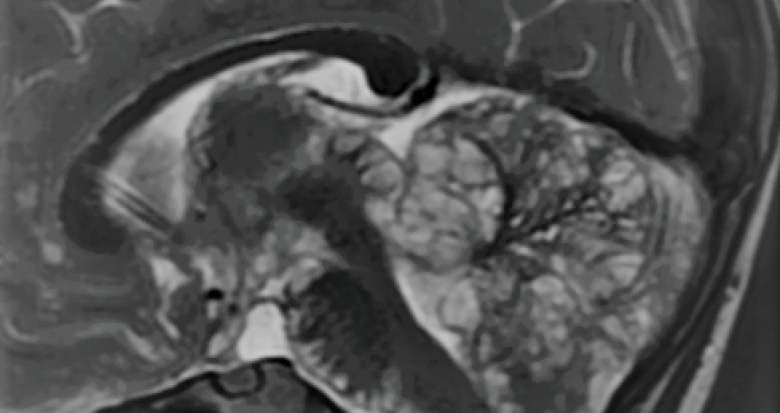
Et la MGMT ? Connue depuis longtemps maintenant, la classification WHO la boude et elle n’en fait donc toujours pas partie bien qu’elle soit un marqueur de chimiosensibilité et de pronostic indépendant. La prise de contraste, quant à elle, reste un indicateur de malignité. Chez les enfants, la mutation du gène de l’histone H3 est caractéristique et est retrouvée dans plus de 80% des cas. De façon plus spécifique, les tumeurs méningées avec l’hémangiopéricytome (ou tumeur fibreuse solitaire) s’identifient par la présence de microkystes et l’absence de « dural tail ». Les méningiomes sont toujours séparés en 3 grades, avec un grade 2 en cas d’invasion cérébrale ou d’hétérogénéité lésionnelle. Enfin, des données récentes font leur apparition comme les MVNT (tumeurs neuronales multinodulaires à vacuoles) ou les tumeurs leptoméningées glioneuronales (Fig. 1).
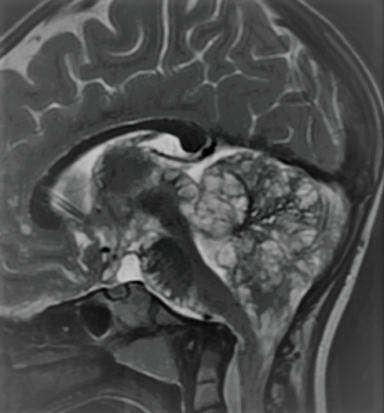
Figure 1. Tumeur leptoméningée glioneuronale avec ses images en rosettes sous piales caractéristiques.
S. Grand nous parle ensuite du suivi des tumeurs cérébrales et de l’importance cruciale de connaître le schéma thérapeutique. L’association entre la chirurgie, la radiothérapie, la chimiothérapie et maintenant l’immunothérapie peut ainsi être à l’origine de nombreuses images pièges. Prenons l’exemple de l’irradiation, dans laquelle on observe une atteinte vasculaire initiale puis une démyélinisation, conduisant à des images de pseudoprogression. Celles-ci se caractérisent par des lésions inflammatoires et la rupture de la barrière hémato-encéphalique ; les critères diagnostiques devant alerter sont l’augmentation d’au moins 25% de la taille tumorale suivie d’une stabilité sur au moins 6 mois, ou encore l’absence de progression depuis 2 mois après une augmentation de taille précoce. La perfusion T2* met en évidence l’absence d’augmentation du volume sanguin cérébral (VSC). L’accent est ensuite mis sur le PIPG (peri-ictal pseudoprogression) ou le SMART (stroke like migraine attacks after radiation therapy), des formes particulières de pseudoprogression se caractérisant par des crises d’épilepsie ou des céphalées sévères.
Finalement, F. Cotton nous présente de nombreux cas de neuroradiologie dont nous sommes friands, les « 1 image/1 diagnostic », on apprend ainsi que le seul profil moléculaire où la créatine augmente est la gliomatose, que le gliome chordoïde du V3 présente une localisation précise en regard de la ligne médiane et que le pic d’alanine signe le méningiome de façon typique comme le pic de taurine pour le médullome desmoplastique.