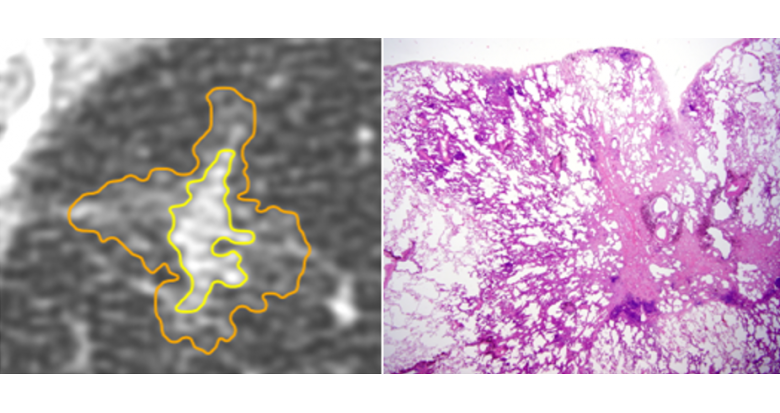
J. Cohen (Grenoble) ouvre la session sur les lésions pré- et minimalement invasives. La composante en verre dépoli des lésions pré-invasives correspond en général à une prolifération lépidique. Même s’il existe un chevauchement de l’aspect radiologique des lésions pré-invasives, l’atypie adénomateuse hyperplasique apparaît sous forme d’un verre dépoli (VD) pur de moins de 5 mm alors que l’adénocarcicome in situ mesure généralement plus de 5 mm. L’adénocarcinome minimalement invasif est fréquemment un nodule mixte avec composante solide <5 mm au scanner (Fig. 1). Il ne faut pas méconnaître la forme solide mucineuse. Il est essentiel de confirmer la persistance du nodule, par un scanner à 3-12 mois, car 30-70 % régressent spontanément. Le nodule en VD peut évoluer selon sa taille, sa densification ou l’apparition d’une composante solide. Il est rappelé que les acquisitions doivent se faire en coupes fines (<1.25 mm) et que le minIP sensibilise la détection des lésions en verre dépoli ou mixtes. La prise en charge est basée sur les critères morphologiques, selon les recommandations de la Fleischner Society 2017, sans oublier les facteurs de risque et le contexte clinique.
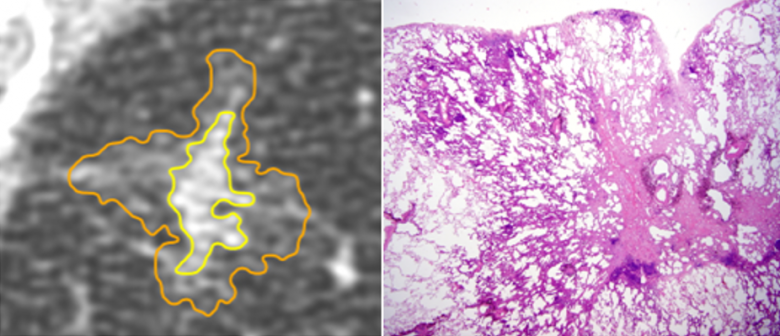
Figure 1 : Corrélation anatomo-pathologique d’un nodule mixte.
M. Lederlin (Rennes) poursuit sur les carcinomes bronchiques invasifs majoritairement représentés par l’adénocarcinome (50%), définis par un contingent invasif de plus de 5mm. L’adénocarcinome à prédominance lépidique est de meilleur pronostic et la corrélation radiologique avec le VD est forte. La mutation EGFR peut être associée à un contingent lépidique et peut se manifester par une miliaire carcinomateuse. Il existe une résistance au traitement par Erlotinib, répondant à l’introduction d’un traitement ciblé par Osimertinib. Il faut savoir reconnaître l’aspect pneumonique des adénocarcinomes mucineux invasifs. Les carcinomes épidermoïdes peuvent s’excaver et induire des hémoptysies, contre-indiquant les anti-angiogéniques. Retenons la chimiosensibilité des carcinomes à petites cellules (CPC) qui sont des lésions centrales et le risque de transformation d’un adénocarcinome muté EGFR TKI-résistant en CPC.
G. Chassagnon (Paris) fait le point sur les tumeurs carcinoïdes bronchiques (TCB) qui sont des tumeurs neuroendocrines rares. Les lésions sont bien limitées, d’évolution lente et peuvent présenter un rehaussement intense évocateur. Les TCB centrales sont symptomatiques par leur retentissement (obstruction bronchique) alors que les TCB périphériques sont habituellement asymptomatiques. Les diagnostics différentiels sont l’hamartome et la métastase unique. Les TCB typiques et atypiques de bas grade fixent à l’octreoscan tandis que les TCB atypiques de haut grade fixent au TEP-scanner au FDG. La DIPNECH doit être évoquée devant l’association de nodules (Tumorlets ou TCB) et d’un parenchyme en mosaïque chez une femme de 60 ans, non tabagique.
L. Cassagnes (Clermont) développe les tumeurs thoraciques rares, à évoquer selon le contexte (absence de tabagisme, syndrome paranéoplasique, <40ans) et la localisation : tumeurs médiastinales antérieures (thymome et myasthénie, tumeur thymique encapsulée nécessitant une chirurgie), cardiaques (sarcome vasculaire et intérêt du temps tardif pour écarter l’embole chronique, lymphome), pulmonaires (lymphome MALT associé au Gougerot, sarcome parenchymateux), pleurales (mésothéliome). Le diagnostic reste histologique. L’IRM a sa place pour le bilan d’extension médiastinal ou pariétal.
C. de Margerie-Mellon (Paris) conclut sur la radiomique, qui permettra une médecine « personnalisée » selon les caractéristiques tumorales. Cela s’applique aux nodules pulmonaires indéterminés (score de risque) et aux cancers pulmonaires avérés (sous-typage histologique, radiogénomique, pronostic, réponse thérapeutique). Cette session a mis en évidence l’importance de la corrélation anatomo-clinique en oncologie thoracique. La radiomique pourra peut-être aider à mieux stadifier les patients dans le futur.
Sandra Calvez
Hôpital Saint-Antoine, Paris