Tous les médecins radiologues intéressés par la recherche clinique ont déjà fait l’expérience lors de leur recueil de données quantitatives de réponses laconiques de leur statisticien, indiquant que leur échantillon numérique ne suit pas la loi « normale » (ou loi de Gauss) et que les analyses vont donc être difficiles. Or nous travaillons sur le corps humain, sur des régions anatomiques qui, par leur complexité (variabilité anatomique chez le sujet sain, plasticité…) ou les processus physiopathologiques intriqués, peuvent entraîner des distributions statistiques irrégulières. C’est tout l’intérêt du « Manifold Learning » (« Analyse de variétés » en français).
En médecine nous sommes souvent confrontés à la problématique suivante : nos jeux de données présentent de multiples dimensions (comme par exemple le volume du signal en IRM, l’échelle de gris en scanner…) qui nécessitent une étape de « réduction » afin de pouvoir être analysés correctement. Le cerveau humain le fait au quotidien, par exemple en extrayant des informations visuelles pertinentes de 10 millions de fibres des nerfs optiques pour nous en simplifier l’intégration.
Jusqu’à la fin du XXe siècle, les analyses statistiques étaient limitées par leur impossibilité à capturer les degrés de liberté non linéaires des données. Un exemple de la vie courante est la reconnaissance automatique de visages, comme elle est pratiquée en Chine : il suffisait que le visage soit de biais ou ombré pour faire échouer l’algorithme. En radiologie, de nombreuses start-up butent sur l’interprétation radiologique, par exemple pour détecter automatiquement une fracture fémorale, dès que le cliché est mal centré ou artéfacté par rapport à la base de données d’apprentissage.
L’article fondateur qui a amené le Manifold Learning vers des horizons prometteurs est paru dans Science en 2000, il explique comment « capturer » des degrés de liberté non linéaires pour rendre compte au mieux de la variabilité de nos données cliniques. Cette publication a donné lieu à des développements informatiques « Open Source », nous permettant d’accéder à ces outils gratuitement pour nos études cliniques. Il s’agit d’une sous-classe de Machine Learning (Apprentissage automatique) initialement non supervisé puisque reposant sur une meilleure visualisation de données complexes, sans étiquetage initial entre données « saines » et « pathologiques ». Charge à nous dans un second temps de trouver la meilleure méthode d’analyse pour récupérer une information clinique.
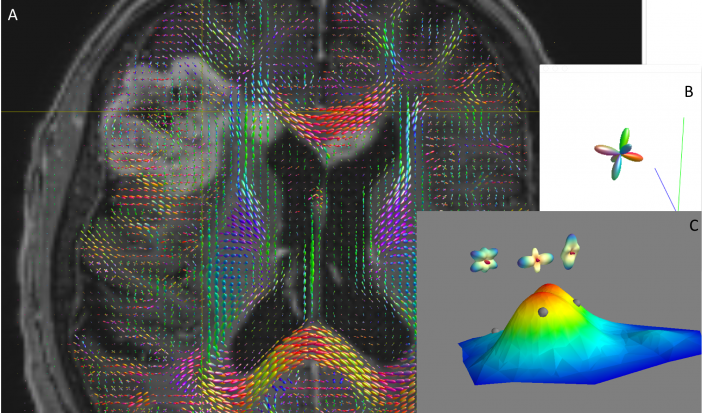
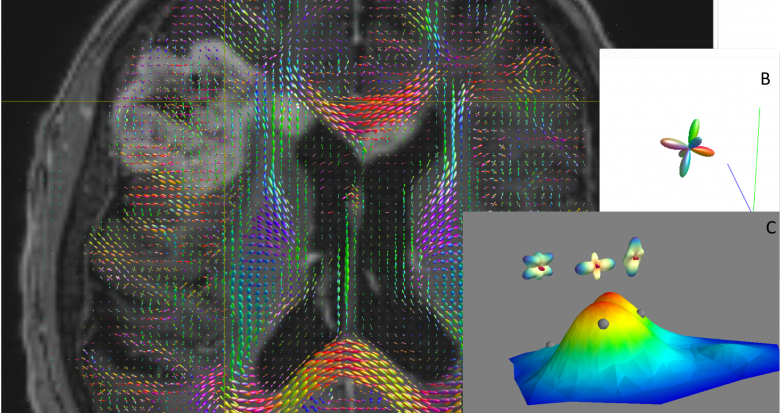
Fig. 1. Exemple d’utilisation du Manifold Learning en IRM de diffusion pour un patient porteur d’un glioblastome. Superposition d’une acquisition en pondération T1 injectée sur l’acquisition de diffusion (A) où le signal est modélisé dans chaque voxel par une petite forme 3D, qui donne l’orientation des fibres dans ce voxel. L’intérêt de la séquence de diffusion en pathologie tumorale cérébrale est sa sensibilité accrue sur les marges d’extension tumorales. Si l’on place son curseur dans la prise de contraste sur l’imagerie T1 injectée, le signal de diffusion dans ce voxel est affiché dans la fenêtre (B). Le constat visuel radiologique évoque une désorganisation des fibres intra-tumorales, surtout si on les compare aux fibres du corps calleux dans sa partie extra-tumorale. Néanmoins, la lésion tumorale est située en région insulo-operculaire et il apparaît plus pertinent de comparer le signal en diffusion du processus tumoral avec le signal de diffusion normal dans cette région anatomique pour un groupe contrôle, qui peut présenter une grande variabilité de diffusion à ce niveau. On construit donc un atlas de la variété des formes (C) dans lequel on a représenté le signal de diffusion de nos contrôles avec des densités de probabilité. Quand on place le curseur dans la tumeur visible ou en dehors, et que la forme de diffusion est proche de celle capturée dans le groupe témoin, il apparaît au sommet de la montagne (dans les zones en rouge). Si la forme de diffusion n’a jamais été rencontrée, donc potentiellement réduite ou contrainte par des cellules tumorales, son point de référence dans l’espace réduit apparaitra loin de la montagne, ce qui signifie que sa densité de probabilité d’être similaire à un voxel présentant une forme de diffusion « normale » est faible.
Un exemple applicatif est donné par l’IRM de diffusion. C’est la seule modalité qui nous permet d’avoir accès à une information quantitative sous la taille d’acquisition de nos voxels, en l’occurrence le mouvement brownien des molécules d’eau. Pour une utilisation radiologique, nous sont fournis à la console des cartes de valeurs scalaires, par exemple le coefficient apparent de diffusion. Or, il s’agit toujours d’une simplification d’un volume de diffusion qui comporte de multiples caractéristiques dans un espace en trois dimensions, le voxel. L’utilisation du Manifold Learning sur l’analyse du signal (façon dont les molécules d’eau se déplacent) permet d’en capturer toute la complexité, de construire un atlas des formes variables chez nos sujets sains et de l’adapter à l’exploration des maladies, qu’elle soit associée à une diminution du signal (atrophie nerveuse, musculaire…) ou à une augmentation de celui-ci (extensions nerveuses péri-tumorales par exemple).
Contrairement au « Deep Learning », efficace mais obscur quant à son fonctionnement, nous maîtrisons ici les étapes de traitement de données de façon compréhensible par le cerveau humain. C’est une façon d’approcher l’intelligence artificielle adaptée aux études avec peu de patients, en s’affranchissant des contraintes du « big data ». Il reste à tester ces nouveaux outils pour ne pas que leur utilisation reste cantonnée à un effet de mode et n’échappe aux radiologues.
Arnaud ATTYE
Clinique Universitaire de Neuroradiologie et d’IRM, CHU Grenoble
Félix RENARD
Clinique Universitaire de Neuroradiologie et d’IRM, CHU Grenoble
En savoir +
Séance scientifique
Séance de communications orales - Intelligence artificielle et machine learning en imagerie médicale