Sébastien Mulé, Athena Galletto Pregliasco, Frédéric Pigneur, Marjane Djabbari, Laurence Baranes, Rym Kharrat, Alain Luciani – Imagerie médicale, CHU Henri Mondor
L’usage des produits de contraste en scanner a fait l’objet d’une actualité riche ces derniers mois. En effet, bien que l’injection d’un produit de contraste iodé au cours d’un examen tomodensitométrique soit très fréquente dans la pratique clinique d’un radiologue, il existe une grande variabilité inter-centres concernant les protocoles d’injection mis en place.
Les débats actuels ont vocation à faire évoluer les protocoles d’injection au sein de la communauté des radiologues, à les harmoniser autour d’un rationnel commun. Et ce rationnel renvoie d’abord à notre rôle de médecin ; il s’agit avant tout de justifier de l’usage d’un agent de contraste, d’évaluer les possibilités de substitution vers un examen n’utilisant pas de produits de contraste iodés – IRM avec séquences de diffusion par exemple (1) – puis d’utiliser de la manière la plus juste l’emploi d’un produit de contraste iodé. Cette dernière étape n’est pas la moins complexe. Elle doit s’adapter à la fois au patient et à l’organe d’intérêt, ainsi qu’au contexte clinique spécifique. Ces éléments sont patents dans le cas d’école représenté par l’exploration du foie – pour lesquels le type d’acquisition TDM et l’injection de produit de contraste varient, qu’il s’agisse d’une exploration monophasique en phase protale veineuse dans un contexte d’altération de l’état général ou d’une acquisition multiphasique incluant un temps tardif à 5 minutes pour la caractérisation de lésions nodulaires sur foie de cirrhose. La SIAD participe à cette évaluation scientifique, en lien avec le CIRTACI et la SFR. La quantité totale d’iode injectée est l’élément déterminant pour une étude parenchymateuse optimale – à titre d’exemple, la cible optimale est de 525 à 600 mg d’iode/kg pour une exploration hépatique (2), quand la quantité d’iode délivrée par seconde prime pour une étude vasculaire (3). En parallèle, les doses injectées doivent être adaptées au poids du patient aujourd’hui (4), à son pourcentage de masse maigre (peut-être) demain (5).
Et que dire de l’apport des techniques d’imagerie TDM mises en jeu ? L’optimisation du contraste dans l’image passe aussi par l’optimisation de l’instrumentation TDM. La possibilité d’obtenir des images de bonne qualité diagnostique à plus faible kilovoltage, la généralisation des méthodes de reconstruction itérative et la diffusion de l’imagerie TDM double-énergie ont profondément changé la donne et doivent aujourd’hui faire évoluer notre pratique lorsqu’il est question d’injecter un produit de contraste iodé au cours d’un examen tomodensitométrique. À titre d’exemple, l’imagerie double-énergie semble permettre de diminuer la dose injectée de 30 à 50% selon l’organe étudié, grâce notamment à la génération de séries d’images "iode-spécifiques" qui offrent une cartographie des prises de contraste, et d’images monochromatiques à basse énergie (de 40 à 70 keV) mais qui présentent un rapport contraste-sur-bruit augmenté (6). Mais ceci ne saurait s’envisager sans une évaluation rigoureuse, pour chaque indication clinique spécifique, chaque morphotype, et intégrant l’ensemble des paramètres d’acquisition concourant à la qualité d’image, notamment la quantité de photon in fine disponible en fonction des machines, et la disponibilité et les évolutions des techniques de reconstruction d’images.
L’innovation technologique, de concert probablement demain avec les apports de l’intelligence artificielle, continueront d’aider les choix du radiologue, au service d’une dose de produit de contraste iodé optimisée mais préservant une qualité image adaptée au diagnostic, à l’utilisation d’algorithmes de traitement d’images, et ainsi à l’évaluation diagnostique ou pronostique attendue. L’usage des produits de contraste iodés doit être au cœur de la médecine personnalisée en imagerie !
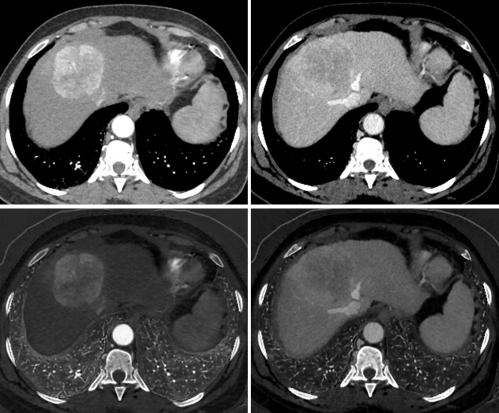
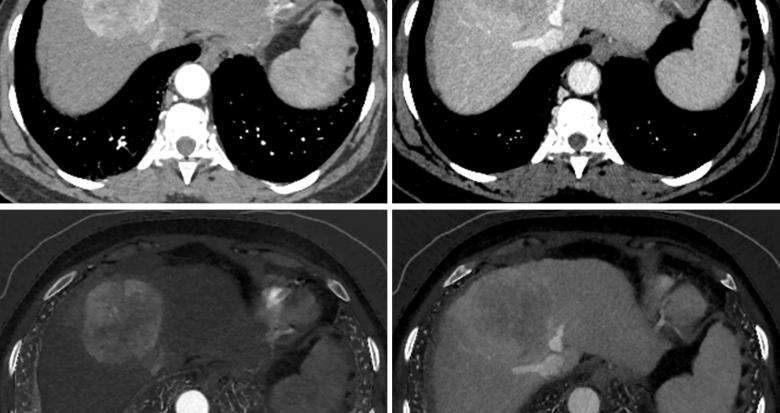
Fig. 1. Acquisition TDM abdominale basse dose (1 ml/kg, concentration 350 mg d’iode/ml, volume injecté 24,2 g d’iode) double énergie aux temps artériel tardif (gauche) et portal (droite) ; images monochromatiques 70 keV (haut) et cartographies d’iode (bas).
Références
- Kwee TC, van Ufford HM, Beek FJ, Takahara T, Uiterwaal CS, Bierings MB, Ludwig I, Fijnheer R, Nievelstein RA. Whole-body MRI, including diffusion-weighted imaging, for the initial staging of malignant lymphoma: comparison to computed tomography. Invest Radiol. 2009;44(10):683-90.
- Kambadakone, AR, Fung, A, Gupta, RT et al. LI-RADS technical requirements for CT, MRI, and contrast-enhanced ultrasound. Abdom Radiol. 2018;43: 56-74.
- Faggioni L, Gabelloni M. Iodine Concentration and Optimization in Computed Tomography Angiography: Current Issues. Invest Radiol. 2016;51(12):816-822.
- Bae KT. Intravenous contrast medium administration and scan timing at CT: considerations and approaches. Radiology. 2010;256:32–61.
- Awai K, Kanematsu M, Kim T, Ichikawa T, Nakamura Y, Nakamoto A, et al. The Optimal Body Size Index with Which to Determine Iodine Dose for Hepatic Dynamic CT: A Prospective Multicenter Study. Radiology. 2016;278(3):773-81.
- Marin D, Nelson RC, Schindera ST, Richard S, Youngblood RS, Yoshizumi TT, et al. Low-tube-voltage, high-tube-current multidetector abdominal CT: improved image quality and decreased radiation dose with adaptive statistical iterative reconstruction algorithm--initial clinical experience. Radiology. 2010;254(1):145‑53.
En savoir +
Séance pédagogique
Recommandations du CIRTACI sur l’optimisation des doses de produits de contraste iodés et gadolinées
15:45 - 17:00
Salle 352B