L’analyse quantitative de l’athérome par angioscanner repose sur une technique bien codifiée : segmentation de la paroi et de la lumière du vaisseau puis discrimination des différentes composantes de la plaque selon leur densité UH (plaque molle, fibreuse, calcique). Cette technique a été amplement utilisée en coroscanner, où elle a aidé à la détermination sémiologique des plaques « à risque », a permis un suivi longitudinal des lésions et a autorisé une comparaison entre patients. Cependant, si les logiciels de quantification sont répandus et faciles d’utilisation, ce type d’analyse n’est que peu appliqué à l’artériopathie oblitérante des membres inférieurs.
Dans la littérature récente, cette technique poursuit trois objectifs de difficulté croissante. Le premier est de parvenir à prédire le risque, par une quantification reflétant la sévérité de l’athérome : technique du « calcium score » quantifiant la charge athéromateuse calcique de la bifurcation aortique jusqu’aux chevilles. Ce score calcique – utilisant les mêmes logiciels qu’en coroscanner – était de manière indépendante un facteur prédictif d’amputation à moyen terme (Huang et al., PloS One, 2014), un marqueur de la sévérité de l’ischémie (Zettervall et al., JVS, 2017) et un facteur de risque d’événement cardiovasculaire indésirable / mortalité totale (Chowdury et al., PLoS One, 2017). Ces constatations (« plus un malade est calcifié, plus il est à risque ») sont peu surprenantes et peu applicables en pratique, car elles nécessitent une acquisition sans injection.
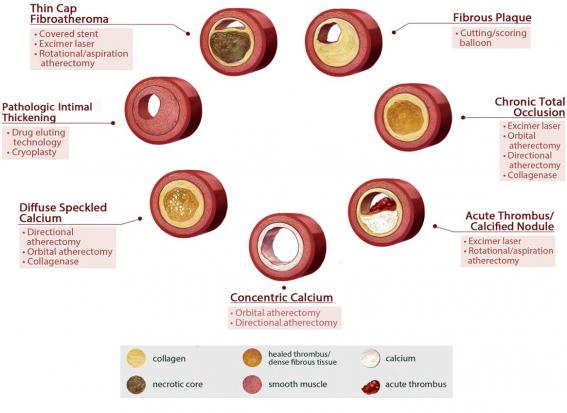
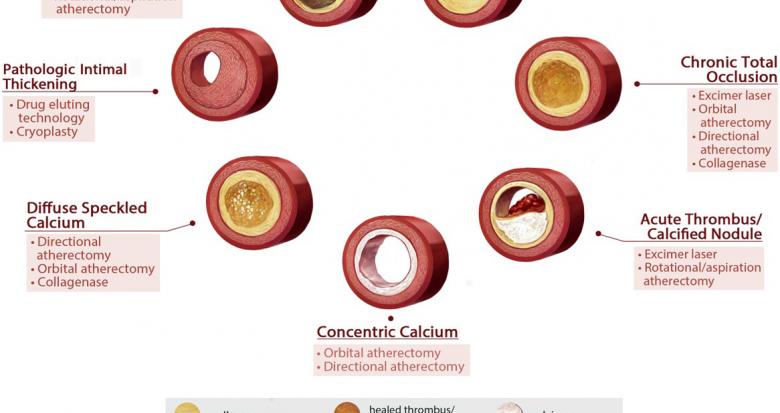
Fig. 1. L’analyse précise de la composition de la plaque athéromateuse pourrait permettre d’optimiser le choix des techniques endovasculaires (d’après Roy et al., Journal of Endovascular Therapy, 2016).
Le deuxième objectif est de parvenir à prédire le devenir des patients, pendant et après traitement. Dans une étude portant sur 74 occlusions fémorales superficielles, il a été trouvé que seule une oblitération calcique complète impactait négativement le taux de succès technique d’une revascularisation percutanée (Itoga et al., JVS, 2017). Le pourcentage total de calcifications, le remodelage négatif ou la présence d’occlusions multiples n’étaient pas corrélés au succès technique. Dans une autre étude portant sur 39 patients avec des lésions fémorales superficielles TASC C/D traitées par stenting, les auteurs retrouvaient une tendance aux thromboses précoces dans les lésions fortement calcifiées et aux thromboses tardives dans les lésions faiblement calcifiées (Kaladji et al., Ann Vasc Surg, 2017). Ils émettaient l’hypothèse qu’un niveau intermédiaire de calcifications pourrait être « favorable » à la perméabilité primaire. Enfin, chez 50 patients avant revascularisation fémoro-poplitée avec quantification UH de la plaque (molle, fibrocalcique et calcique), seul le pourcentage de plaque calcifiée était corrélé à la resténose à 1 an (Patel et al., EJVES, 2015).
Le troisième objectif, non encore atteint, est de parvenir à guider le traitement. L’analyse avancée de la plaque pourrait ainsi permettre de choisir la procédure endovasculaire la plus adaptée et avec le plus de chance de succès. Si la théorie voudrait que certains types de plaques soient mieux adaptés à certains types de traitement (fig. 1), ce raisonnement n’a pour le moment pas encore été validé en pratique.
Au total, l’analyse quantitative avancée de la plaque en angioscanner des membres inférieurs cherche encore ses indications. Il semblerait que la portion calcifiée soit le plus à même de prédire le succès technique et la réponse au traitement. D’autres analyses (quantité ? localisation ? nature des calcifications ?) devraient permettre de progresser sur la question dans les prochaines années.
Mickaël Ohana
Service de Radiologie, Nouvel Hôpital Civil, CHU Strasbourg
Laboratoire ICube, Equipe IMAGeS, UMR 7357, Strasbourg
Nabil Chakfé
Service de Chirurgie Vasculaire et de Transplantation Rénale, Nouvel Hôpital Civil, CHU Strasbourg
Laboratoire GEPROVAS, Strasbourg
Catherine Roy
Service de Radiologie, Nouvel Hôpital Civil, CHU Strasbourg
En savoir +
Séance pédagogique
Ischémie aiguë des membres inférieurs en circuit court : le radiologue du diagnostic au traitement